1. 서 론
온실가스 증가로 인한 이상기후 현상이 세계 곳곳에서 일어나고 있다. 2018년 기후변화에 관한 정부간 협의체(Intergovernmental Panel on Climate Change, IPCC)는 2030년까지 온실가스 배출량을 2010년 대비 45% 감축하고 2050년까지 순배출량을 0으로 만드는 탄소중립을 이루어야 한다고 제언하였으며 이에 탄소중립을 실현하기 위한 움직임이 선진국들을 중심으로 확대되어가고 있다. 이를 위해 재생에너지 보급, 수소경제 활성화 등 탄소 저감 뿐만 아니라 배출되는 탄소를 사후 처리할 수 있는 CCUS 기술이 핵심 수단으로 부상하였다. CCUS는 발전소, 철강, 시멘트, 석유화학 등 산업에서 배출되는 탄소를 포집 및 처리하는 기술로, 기존 생산체계 변경을 최소화하면서 온실가스 감축이 가능하다는 장점이 있다.
CO2 활용기술은 CO2를 바로 사용하는 직접 활용기술과 CO2를 여타 유용한 제품으로 바꾸는 전환기술로 구분되는데 전환기술 중에서도 화학적 전환은 CO2를 화학반응의 원료로 사용하여 연료, 기초화학제품 등 다양한 탄소화합물로 전환하는 방법이다1, 2). 그러나 열역학적으로 안정한 물질인 CO2를 유용한 탄소화합물로 환원하기 위해서는 외부 에너지를 필요로 하며 전기 에너지를 사용하여 CO2를 환원시키는 반응을 전기화학적 CO2 환원 반응(electrochemical CO2 reduction reaction, eCO2RR)이라고 한다. eCO2RR은 전기에너지를 사용하여 두 전극 사이에 전위차를 발생시켜 전자의 이동을 통해 상온, 상압 조건에서 CO2를 환원시킨다. 이러한 환원반응에 의하여 환원 전극에서는 산화전극으로부터 이동한 전자 및 수소 이온이 CO2와 만나 환원 반응을 일으키며, 반응에 참여하는 전자와 수소 이온의 개수에 따라CO, 포름산(formic acid, HCOOH), 메탄올(methanol, CH3OH), 메탄(methane, CH4), 에탄올(ethanol, C2H5OH), 에틸렌(ethylene, C2H4) 등이 생성될 수 있다3).
열역학적으로 표준 상태에서 CO2의 환원 반응은 약 0 V (vs. SHE)에서 일어나지만, 실제 환원 반응에는 더 큰 과전압이 필요하다. 이는 Table 1에 제시된 전위보다 더 음의 전위에서 반응이 진행됨을 의미하며, 반응 속도론을 고려했을 때 -1.0 V 이상의 과전압이 요구된다4, 5). 또한, eCO2RR은 유사한 전위에서 발생하는 수소 발생 반응과 경쟁하게 되며, 이로 인해 생성물 선택성이 저하된다. 따라서, 수소 발생 반응의 과전압이 크면서도 eCO2RR에서 활성을 보이는 촉매 연구가 필수적이다.
Table 1.
Solution resistance (Rs) and charge transfer resistance (Rct) of GDE@Cu electrodes calculated from Nyquist plot
| Rs | Rct | |
| Cu 400s | 3.388 | 88.39 |
| Cu 500s | 3.374 | 70.2 |
| Cu 600s | 3.733 | 59.64 |
eCO2RR의 생성물은 CO2가 금속 전극 표면에 흡착되는 형태, 전극 표면과 탄소, 산소, 수소 간의 상대적 친화력, 그리고 탄소-산소(C-O) 결합을 끊는 활성화 에너지에 따라 크게 달라진다. 대표적인 CO2 환원 촉매로는 일산화탄소(CO) 생성에 높은 선택도를 보이는 금(Au)과 은(Ag) 같은 귀금속 촉매, 그리고 포름산 생성에 유리한 아연(Zn)이 있다6-11). 이들 촉매는 단일 생성물(C1 화합물)을 거의 100%에 가까운 선택도로 생산할 수 있지만, 탄소 원자가 두 개 이상 결합된 C2+ 화합물을 생성할 수 있는 촉매는 현재까지 구리(Cu)가 유일하게 손꼽힌다12-14). 그러나 Cu의 경우 다양한 탄화수소 화합물을 생성할 수 있어 특정 생성물을 높은 선택도로 얻기에는 어려움이 있다. 본 연구에서는 Cu를 가스 확산 전극(GDE) 위에 전기도금하여, 시간이 경과함에 따라 나타나는 CO2 환원 성능의 변화를 보고한다. 전기도금 시간에 따른 Cu의 구조적 변화와 그로 인해 발생하는 전극의 활성 및 선택성 변화를 분석하여, eCO2RR에서 Cu 전극의 장기 안정성과 성능 최적화 가능성을 탐구하였다.
2. 실험방법
2.1 GDE@Cu 전극 제작
GDE@Cu 전극을 제작하기 위해 전기증착법(electrodeposition)을 이용하였다. 기판으로 가스 확산층을 이용하였으며 전처리 단계에서 뒷면에 증착되는 현상을 방지하기 위해 테프론 테이프로 덮어주었다. 전기증착은 potentiostat을 통해 작업전극으로 가스확산층, 상대전극으로 Pt, 기준전극을 Ag/AgCl/KCl을 사용하여 0.01 M의 Cu2SO4와 0.1M의 H2SO4를 혼합한 용액내에서 -2.5 mA/cm2의 일정한 전류밀도를 유지해주면서 진행하였다. 400s, 500s, 600s 동안 진행하여 증착시간이 다른 3가지 샘플을 제작하였으며, 진행 후 증류수로 rinsing하고 테이프를 벗겨 오븐에서 열처리해주었다.
2.2 특성 분석
제작된 샘플의 표면 형태 및 특성은 전남대학교 에너지융복합전문핵심연구지원센터의 주사전자현미경(FE-SEM, SU5000/Hitachi)을 이용하여 관찰하였다. 표면 구성 성분은 FE-SEM에 부착된 EDS (Energy Dispersive X-ray Spectrometer)을 통해 확인하였다. 샘플의 결정구조 및 상분석은 X-ray 회절 분석법(XRD, EMPYREAN/Malvern Panalytical)를 통해 조사하였다.
2.3 전기화학적 특성 분석
제작된 전극의 전기화학적 특성을 분석하기 위해 전압 인가 장치인 potentiostat (WonATech)을 이용하였다. 3전극 시스템을 구성하여 제작된 GDE@Cu, bare GDE, Ag/AgCl/KCl을 각각 작업전극, 상대전극, 기준전극으로 사용하였다. 전기화학 반응기는 Nafion N-117 멤브레인을 포함한 flow type의 CO2 환원용 모듈(s-technology)을 제작하여 사용하였다. 이때, 전해질은 양극액, 음극액 모두 0.1 M KOH를 사용하여 전기화학적 특성을 관찰하였다. CO2 환원 성능은 -0.6 V (vs. RHE) 전압을 인가해주며 1시간동안 평가하였으며, 반응 과정에서 발생된 생성물은 기체 크로마토그래피(GC, SN70100633/Inficon)과 액체 크로마토그래피(LC, 1260 infinity II/Agilent Technologies)를 이용하여 분석하였다. 모든 과정에서 기준 전극에 대한 전압(vs. Ag/AgCl/KCl)을 표준전극에 대한 전압(vs. RHE)으로 변환시켜주기 위해 Nernst equation을 사용하였다.
3. 결과 및 고찰
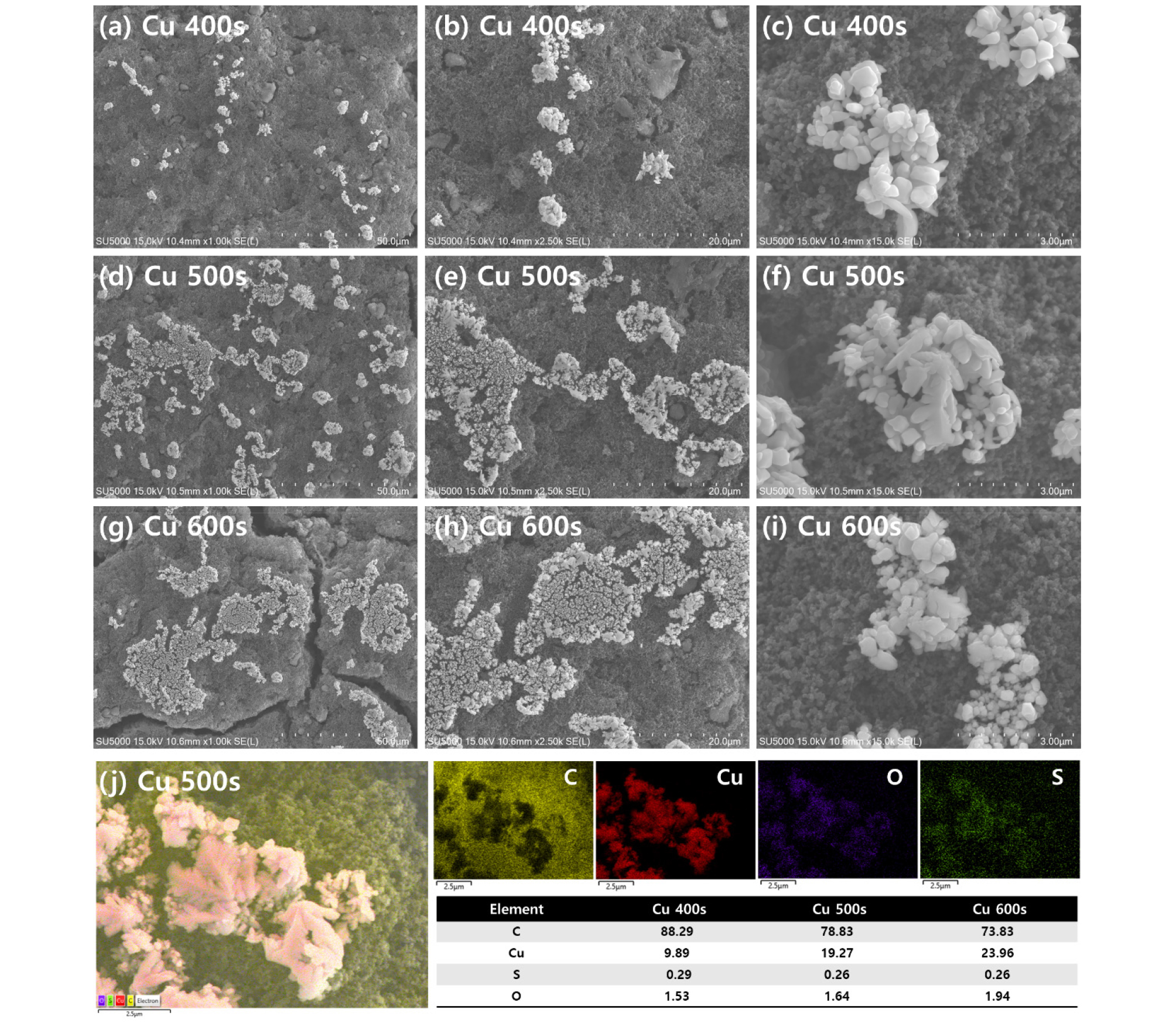
제작된 샘플의 표면을 분석하기 위해서 주사전자현미경(Scanning Electron Microscope, SEM) 분석을 진행하였으며, Fig. 1에 나타내었다. Fig. 1은 증착 시간에 따른 샘플의 저·고배율SEM 이미지와 EDS mapping 결과를 나타낸다. 저배율 SEM이미지에서 탄소로 이루어진 조밀한 가스확산층 위로 전기 증착을 통해 형성된 Cu 결정이 분포되어 있는 모습이 관찰되었다. 400s, 500s, 600s의 증착 시간으로 가스확산층을 전부 덮기엔 부족한 것으로 판단된다. 고배율 SEM 이미지에서 알 수 있듯이 형성된 결정 크기는 ~1 um 단위로 증착 시간이 증가할수록 결정입자들이 가스확산층 위에 더 많이 분포되어 있음을 확인하였다.
Fig. 1(j)의 EDS Mapping 결과는 Cu 500s 샘플의 C, Cu, O, S 원소에 해당하는 이미지를 대표적으로 나타내며, 표는 모든 샘플에서 각 원소들이 차지하는 wt%를 나타낸다. O와 S는 전해질에 기인하는 결과이며, 시간이 증가할수록 Cu 원소의 wt%가 증가하고 C의 wt%는 감소함을 알 수 있다. 위 결과들을 종합해보았을 때, 가스 확산층 위에 증착된 물질이 Cu이며 전기증착을 통해 물질이 성공적으로 형성되었다고 판단할 수 있었다.
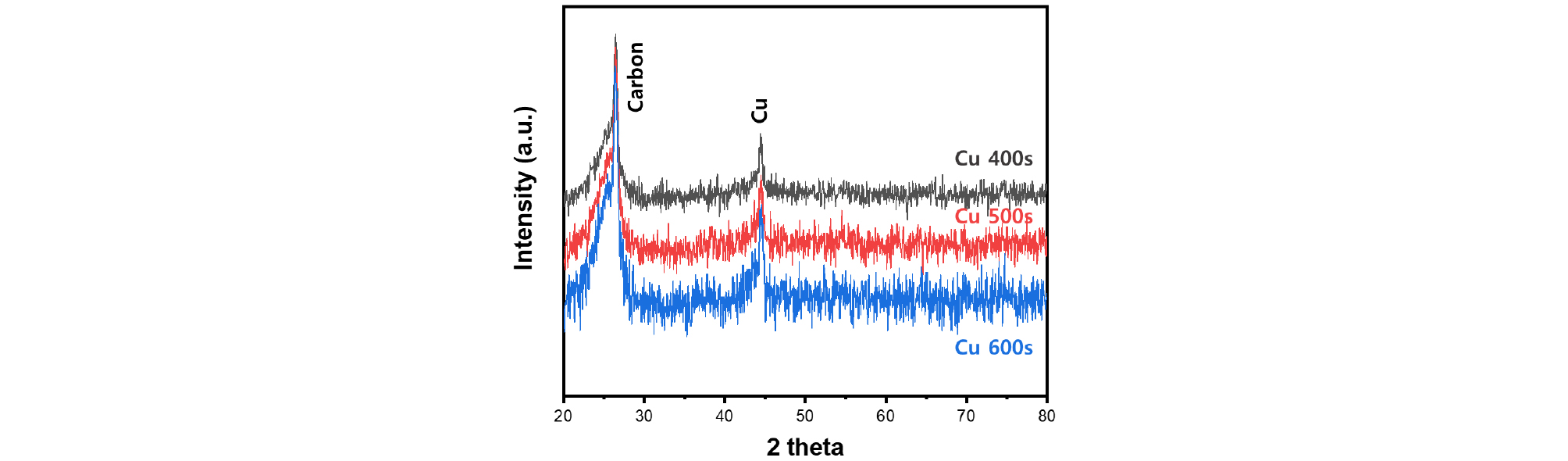
증착시간에 따른 결정학적 특성의 변화를 관찰하기 위해 XRD 분석을 진행하였다. Fig. 2은 분석을 통해 얻은Cu 400s, Cu 500s, Cu 600s의 XRD 패턴을 나타낸다. 모든 샘플에서 두가지의 뚜렷한 피크가 확인되었다. 가스확산층의 주요 성분인 탄소를 나타내는 Carbon peak 와 증착된 Cu를 의미하는 peak가 26.5°, 44.5°에서 나타났으며, 증착된 시간이 증가할수록 Cu 피크 세기가 더 강함을 알 수 있었다15). 이는 SEM 이미지와 일치하는 결과로 증착시간이 증가하여 가스확산층에 분포된 Cu 결정 입자의 분포도가 더 높아졌기 때문으로 판단된다.
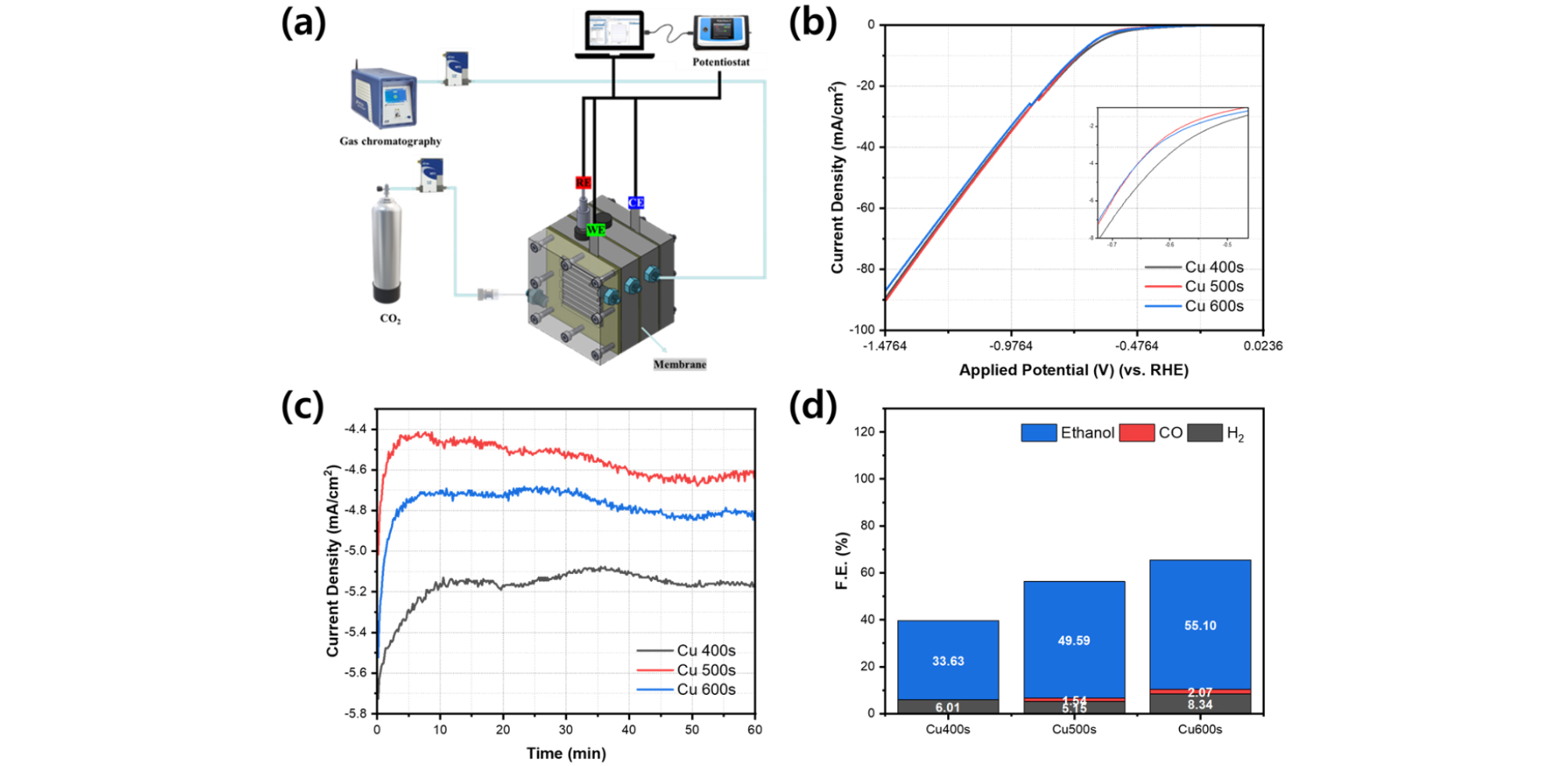
증착시간에 따른 전기화학적 특성 및 CO2 환원 성능의 차이를 살펴보기 위해서 CO2RR 시스템을 이용하여 실험을 진행하고 그 결과를 Fig. 3에 나타내었다. Fig. 3(a)는 사용된 CO2RR 시스템의 모식도이다. 제작된 flow type cell에 Gas chromatography와 potentiostat을 연결하여 특성을 평가하고, 실시간으로 반응을 통해 얻어지는 생성물을 분석하였다. Fig. 3(b)는 Cu 400s, Cu 500s, Cu 600s 샘플의 선형주사전위법(Linear Sweep Voltammetry, LSV)을 통해 얻은 그래프이다. Inlet의 그래프는 -0.75 V부터 -0.45 V vs. RHE전압 범위에서 확대된 LSV 그래프이다. 세가지 샘플 모두 같은 범위에서 유사한 전류값을 보였으며, -0.6 V vs RHE 전압에서 전류값을 비교했을 때 Cu 400s, Cu 600s, Cu 500s 순으로 높은 전류값을 보였다.
제작된 샘플의 CO2 환원 성능을 평가하기 위해 0.1M KOH 전해질에서 -0.6 V vs. RHE 전압을 인가해주면서 1시간동안 CO2 환원 성능을 평가하고, 이를 통해 측정된 생성물로 Faraday Efficiency(FE)를 계산한 결과를 Fig. 3(d)에 나타내었다. Fig. 3(c)는 CO2 환원 성능 평가 중 측정된 각 샘플의 시간대전류법 (chronoamperometry) 그래프이다. Fig. 3(d)에서 각각 검정색은 수소, 빨간색은 일산화탄소, 파란색은 에탄올 생성물을 의미한다. 세가지 샘플 모두에서 공통적으로 수소와 에탄올이 생성됨을 확인하였다. Cu 500s, Cu 600s의 경우 일산화탄소도 관찰되었다. 증착시간이 증가할수록 에탄올의 FE가 증가하는 경향을 보였고 55.10%로 Cu 600s가 에탄올에 대한 가장 높은 선택도를 보였다. 뿐만 아니라, 증착시간이 증가할수록 모든 생성물에 대한 FE의 총 합도 Cu 600s 샘플이 65.51%로 가장 높았다.
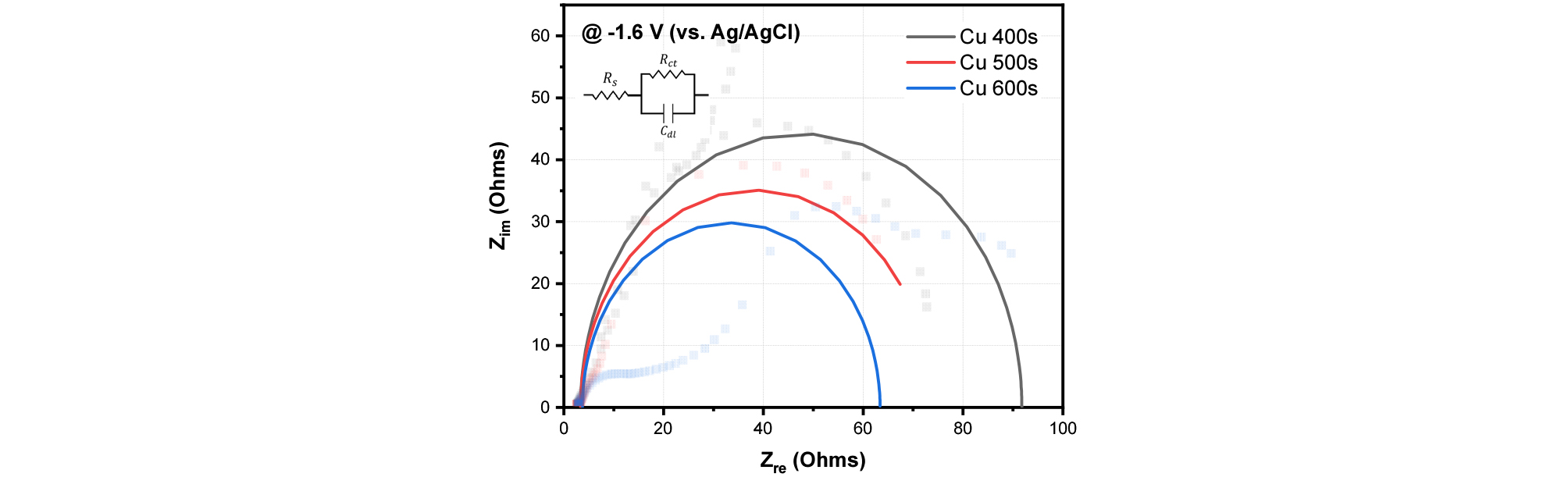
Cu 600s에서 가장 높은 CO2 환원 성능을 보인 이유를 분석하기 위해서 EIS (Electrochemical Impedance Spectroscopy) 분석을 수행하였다. Fig. 4는 EIS를 통해 얻은 제작된 샘플의 Nyquist 그래프이다. Nyquist 그래프에서 반원의 크기는 고주파 영역과 저주파 영역에서 비교할 수 있으며, 고주파 영역에서 반원의 크기(Rs)는 용액저항, 저주파 영역에서 반원의 크기는 전하 전달 저항(Rct)을 의미한다16). 관찰된 Rs와 Rct의 수치를 Table 1에 정리하였다. 그래프와 표에서 볼 수 있듯이 Cu 600s 이 가장 작은 Rs와 Rct값을 보이고, 증착시간이 감소할수록 Rs와 Rct값이 증가하는 것을 확인하였다. 작은 반원의 크기는 촉매가 전하전달을 더 잘 촉진함을 시사하며 이는 촉매-전극 결합의 강도나 표면 반응성을 높이는 요인으로 작용할 수 있기 때문에 Cu 600s에서 가장 높은 효율의 CO2 환원 성능을 보였다고 판단된다.
4. 결 론
본 연구에서는 전기증착법을 이용하여 증착 시간에 따른 CO2 환원용 GDE기반 Cu 음극을 제작하고, 전기화학적 특성 및 CO2 환원 성능을 비교하였다. SEM과 EDS Mapping을 이용한 표면 및 성분 분석을 통해 GDE 위에 Cu가 성공적으로 형성됨을 확인하였다. XRD분석으로 증착시간에 따른 결정학적 변화를 확인하였으며, flow type의 시스템을 구성하여 전기화학적 특성을 확인하였다. CO2 환원 성능을 비교해보았을 때 세 전극 모두에서 수소, 일산화탄소, 에탄올이 관찰되었으며 증착 시간이 증가할수록 에탄올의 FE가 증가하여 Cu 600s에서 최대 55% 이상의 생성 효율을 보였다. 이러한 결과에 대한 원인으로는 active site로의 전자 전달 효율이 향상되었다는 점을 들 수 있으며 이는 각 전극에 대하여 측정한 EIS 결과로부터 추론할 수 있었다. 이로부터 Cu 금속이 eCO2RR에서 C2 탄화수소 화합물을 생성할 수 있는 촉매임을 확인하였으며, 전자의 전달 저항이 CO2 환원의 효율 증가에 영향을 미칠 수 있는 변수임 또한 확인하였다. 본 연구의 결과는 CO2 환원 반응을 위한 전극 설계 및 최적화에 있어 촉매의 전자 전달 특성의 중요성을 시사한다.